接上篇,8个月9篇CNS,Bio X Cell新晋顶流之CSF-1R抗体(上)
9月10日,Nature在线发表论文“Myeloid progenitor dysregulation fuels immuno-suppressive macrophages in tumours”,成为Bio X Cell CSF-1R抗体(克隆AFS98)今年的第10篇CNS主刊文献。如需购买Bio X Cell公司产品,请联系Bio X Cell授权一级代理商欣博盛生物。

近年来,深入解析髓系细胞尤其是单核-巨噬细胞在肿瘤微环境(TME)中的免疫调控作用,并在此基础上探索免疫治疗的潜力,已成为一个研究热点方向。这期就让我们跟着CSF-1R抗体的顶刊文献来学习相关的前沿进展。
TME中巨噬细胞介导的过继性T细胞清除
去年Nature发表了一项联用过继性T细胞疗法和CD47抗体的探索性研究,却发现不仅没有协同增强,反而完全丧失了细胞治疗原有的获益。
原来输注的CAR-T/TCR-T细胞会招募巨噬细胞到肿瘤内,而且本身CD47表达就比较低,再联用CD47抗体,进一步降低“别吃我”的信号,导致强效且迅速的巨噬细胞吞噬。而在清除了巨噬细胞之后,即使给药CD47抗体,小鼠体内的CAR-T细胞也不被清除,证实CD47抗体诱导的T细胞清除由巨噬细胞介导[1]。
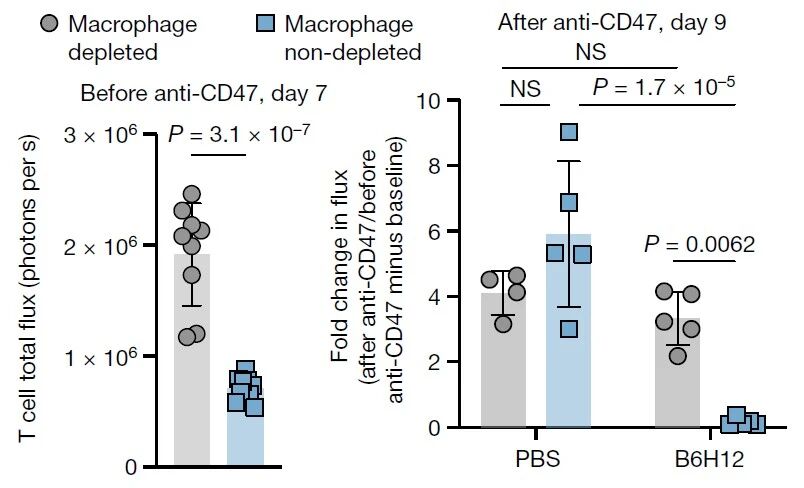
Nalm6白血病小鼠清除巨噬细胞后,CD19-28ζ CAR-T联合给药CD47抗体(B6H12),CAR-T细胞不再减少
为了克服这一挑战,作者在过继性T细胞中表达工程化改造的CD47变体CD47(Q31P),维持与SIRPα结合的同时不被CD47抗体阻断,在与CD47抗体联用时协同增强抗肿瘤效应。
在上篇中我们提到过小分子抑制剂和单抗是两类常用的CSF-1R抑制剂,这项研究结合了两者来清除小鼠体内的巨噬细胞。预处理时静脉注射200μl氯膦酸脂质体加腹腔注射400μg CSF-1R抗体,实验期间再每周三次给药400μg CSF-1R抗体,流式分析验证CD11b+/F4/80+巨噬细胞清除。
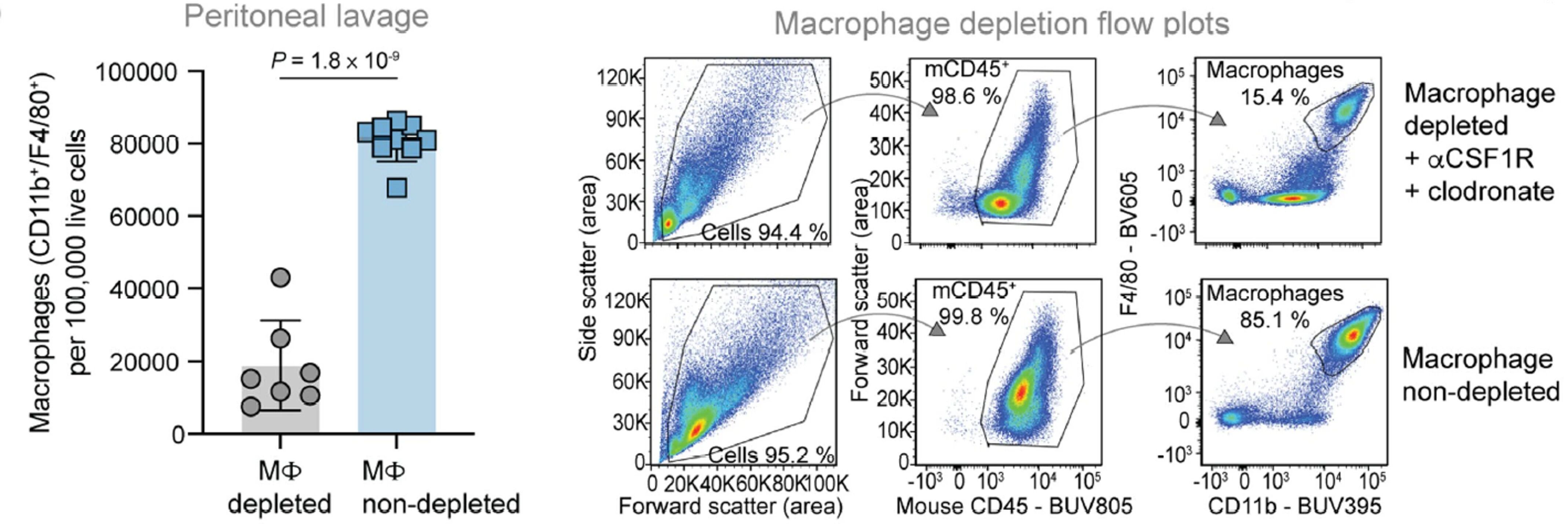
预处理后第13天腹腔灌洗样本流式分析验证CD11b+/F4/80+巨噬细胞清除
远端髓系祖细胞失调助长免疫抑制性巨噬细胞
除了TME中的免疫抑制性单核来源巨噬细胞(mo-mac),肿瘤还能增强髓系造血不断补充这些细胞。为了解决这一“源头”问题,9月最新的Nature研究对NSCLC临床样本和模型小鼠进行了单细胞转录组与染色质可及性的联合分析,鉴定到肿瘤诱导骨髓中髓系祖细胞表观遗传重编程的关键因子Nfe2l2(NRF2)。基因敲除或使用药物抑制NRF2能够显著降低TME中mo-mac的存活与免疫抑制作用,恢复NK细胞和T细胞的抗肿瘤免疫功能,增强免疫检查点抑制剂的疗效[2]。
在肺癌(KrasLSL-G12D/+;Trp53fl/fl)小鼠模型中,隔天注射400μg Bio X Cell的CSF-1R抗体清除单核细胞和巨噬细胞,NRF2正常的对照组中肿瘤负荷显著降低,而NRF2缺陷小鼠(Nfe2l2ΔMs4a3)没有明显的附加效应,表明NRF2激活后是通过mo-mac介导免疫抑制。
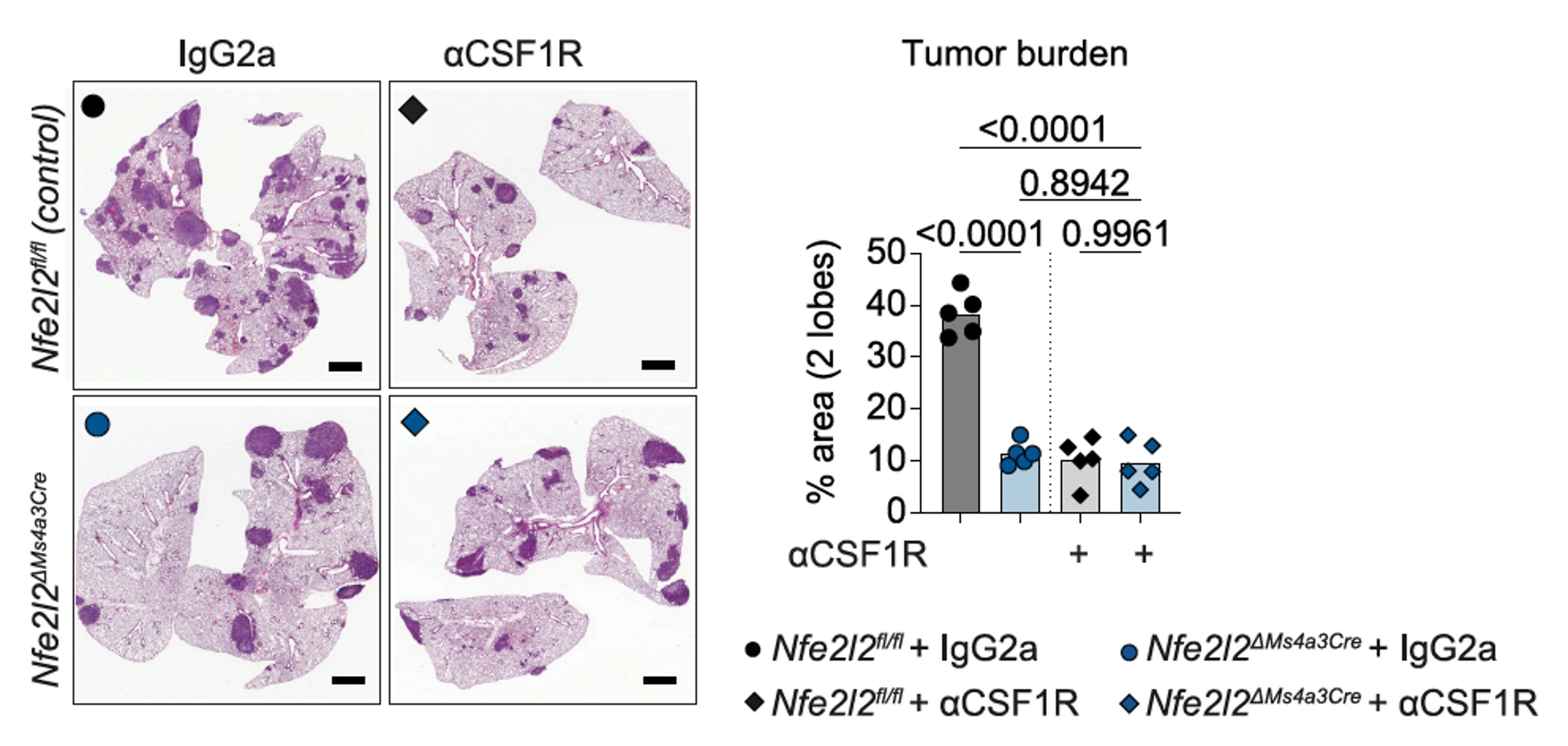
接受CSF-1R抗体或同型对照抗体治疗的KP肿瘤小鼠的典型组织学图像及肿瘤负荷
B细胞淋巴瘤的CAR-T辅助治疗
8月的一篇Cancer Cell论文尝试从TME角度破解复发/难治性侵袭性B细胞淋巴瘤(B-NHL)的CAR-T耐药问题,采用单细胞测序、成像质谱流式、MACSima成像循环染色等多种高维技术分析临床样本,系统比较了持续应答和非持续应答病人治疗前后的细胞样本,鉴定到与预后相关的CSF-1R+CD14+CD68+淋巴瘤相关髓系-单核(lympohma-associated myeloid-monocytic,LAMM)细胞,能够抑制CAR-T细胞的增殖与杀伤功能[3]。
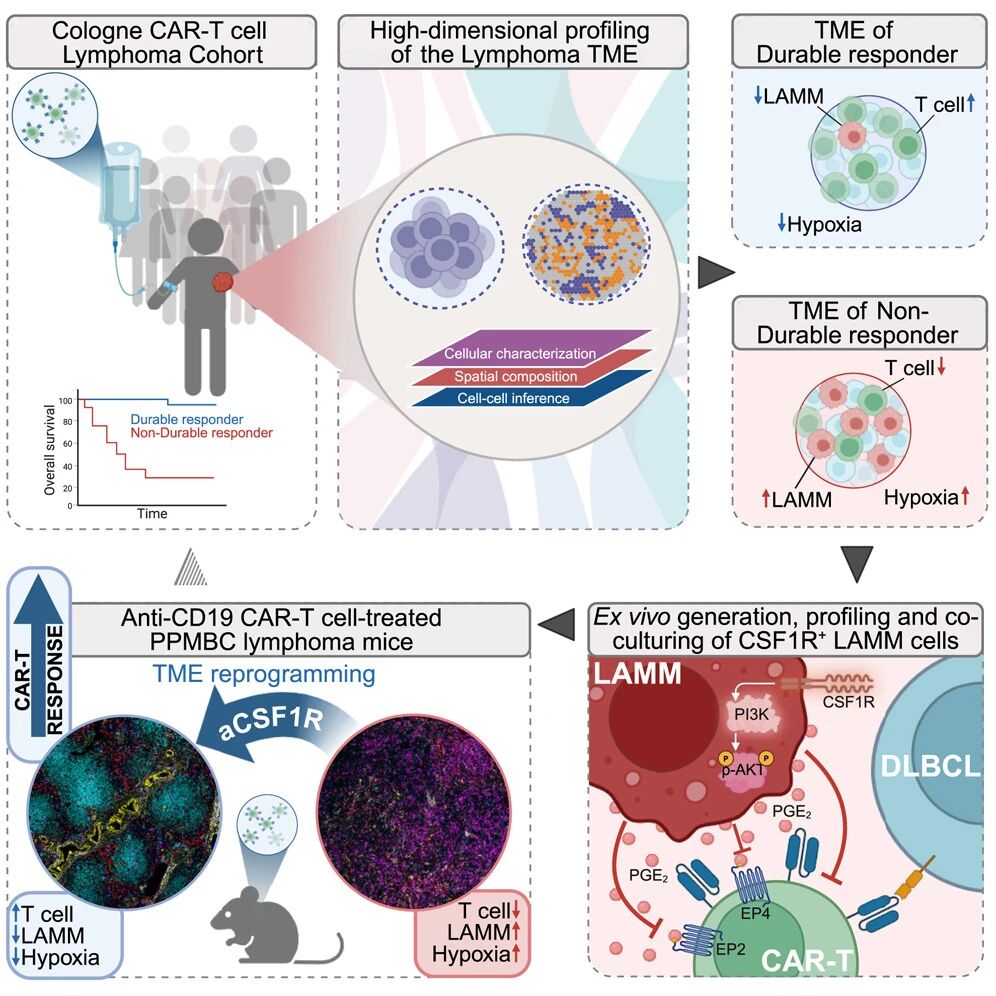
在具备完全免疫功能的原发性DLBCL小鼠模型中,CD19 CAR-T细胞与CSF-1R抗体联用产生协同效应。具体方案为从CAR-T细胞回输前2天开始腹腔注射Bio X Cell的CSF-1R抗体,每剂400μg(相当于16mg/kg体重),每周三次,直至CAR-T回输后28天,在转录和蛋白水平上均验证LAMM有效清除。CSF-1R抗体联用相比CAR-T单药治疗,显著改善PFS,并提高了持续CR的小鼠数量,大大延长OS。
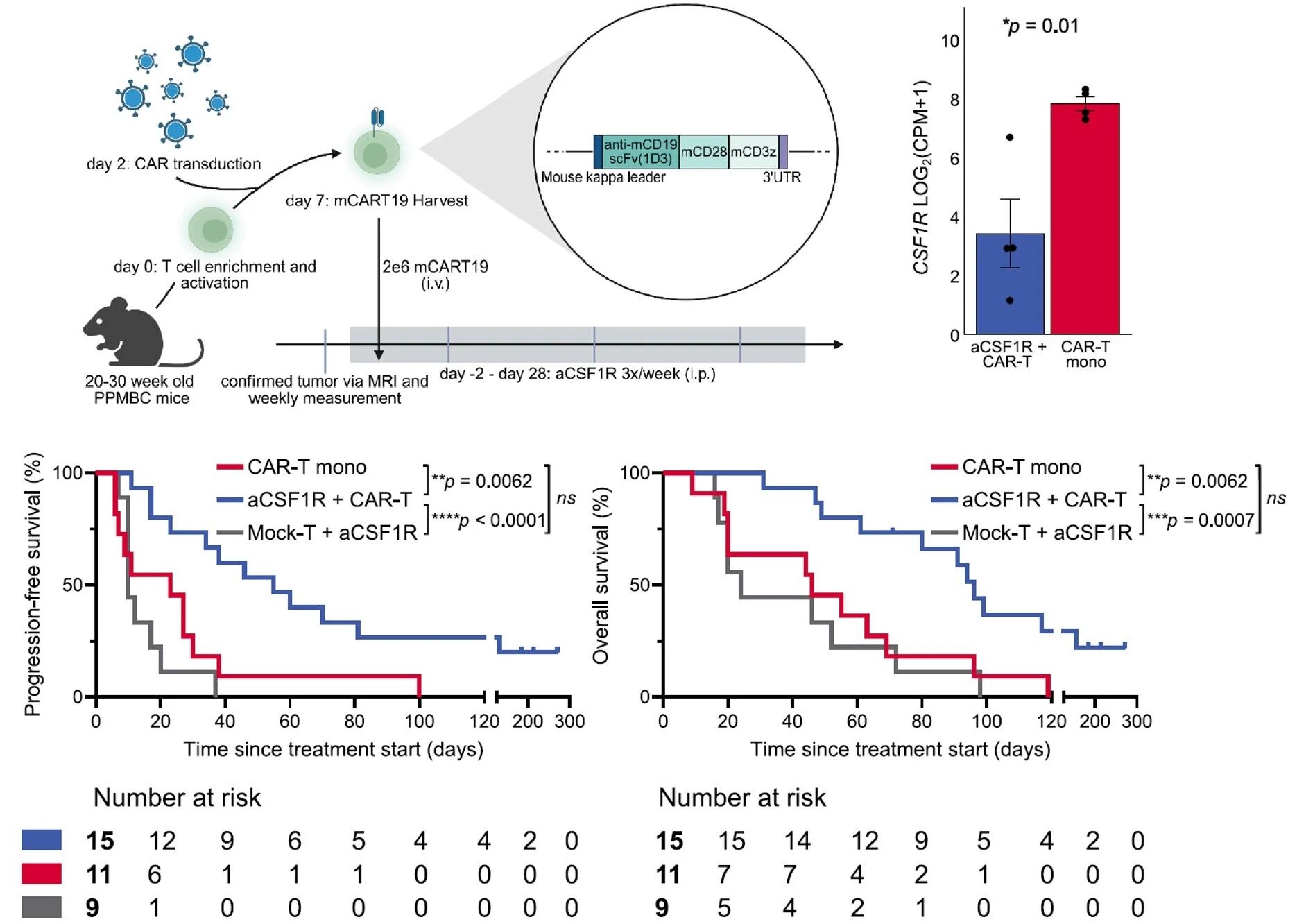
CSF-1R抗体与CD19 CAR-T细胞联合治疗对原发性DLBCL小鼠产生协同效应,显著延长PFS和OS
CSF-1R低表达TAM驱动的前列腺癌耐药
尽管取得了一些积极的结果,CSF-1R抑制剂的临床应用并非一帆风顺,比如其对于转移性去势抵抗性前列腺癌(mCRPC)的抗肿瘤活性就有限。今年初的一项Nature研究应用单细胞转录组测序在病人活检样本和同源小鼠模型中共同鉴定到一类新型免疫抑制性巨噬细胞亚群SPP1hi-TAM,高表达Spp1低表达Csf1r,解释了CSF-1R抑制剂疗效不理想的原因[4]。
为确定SPP1hi-TAM是否耐受CSF-1R阻断,当小鼠发展为CRPC(肿瘤体积达100–200mm3)时随机分为两组,分别腹腔注射1mg Bio X Cell的小鼠CSF-1R抗体或对应的同型对照抗体,5天后给予0.5mg抗体(溶于200μl PBS)维持,2天后流式分析的结果表明SPP1hi-TAM对CSF-1R阻断不敏感。
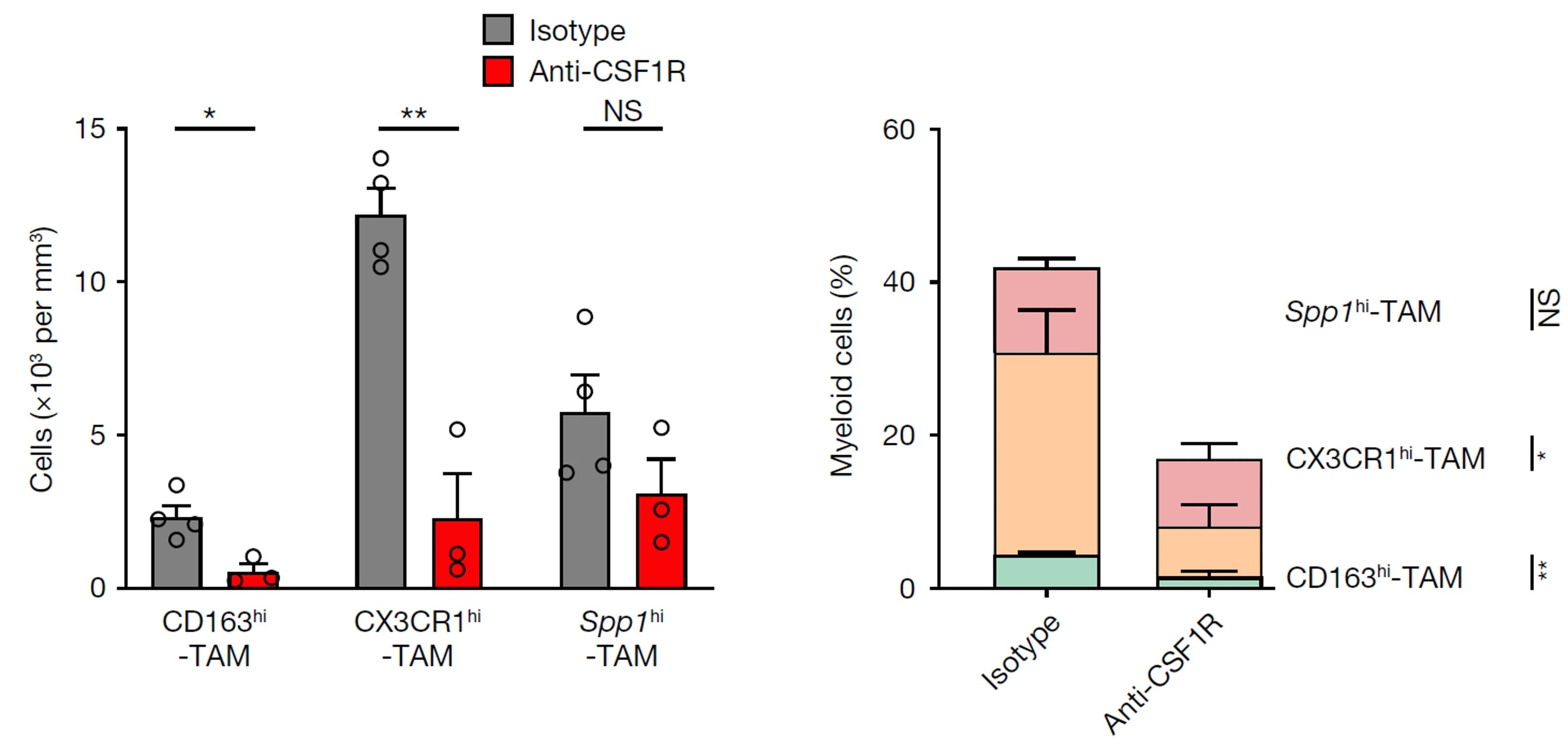
CSF-1R抗体在CRPC小鼠体内显著清除CD163hi-TAM与CX3CR1hi-TAM,而SPP1hi-TAM基本不受影响
进一步分析发现SPP1hi-TAM介导免疫治疗耐药可能是通过腺苷信号转导。使用ciforadenant抑制腺苷A2A受体,联合阿特珠单抗(atezolizumab)阻断PD-L1,可在mCRPC患者中诱导临床反应。
这些应用Bio X Cell CSF-1R抗体获得的新发现让我们愈发感受到TME调控肿瘤免疫的重要性,无论是免疫检查点抑制剂还是过继性细胞治疗,解除TME中的免疫抑制都能与之有效协同。而Bio X Cell则为研究者提供可靠的功能级抗体,助力进一步探索髓系细胞异质性,见证科学突破。
参考文献:
1. Yamada-Hunter, SA, et al (2024) Engineered CD47 protects T cells for enhanced antitumour immunity. Nature. 630(8016):457-465. doi: 10.1038/s41586-024-07443-8.
2. Hegde, S, et al (2025) Myeloid progenitor dysregulation fuels immunosuppressive macrophages in tumours. Nature. doi: 10.1038/s41586-025-09493-y. Online ahead of print.
3. Stahl, D, et al (2025) CSF1R+ myeloid-monocytic cells drive CAR-T cell resistance in aggressive B cell lymphoma. Cancer Cell. 43(8):1476-1494. doi: 10.1016/j.ccell.2025.05.013.
4. Lyu, A, et al (2025) Evolution of myeloid-mediated immunotherapy resistance in prostate cancer. Nature. 637(8048):1207-1217. doi: 10.1038/s41586-024-08290-3.
更多产品详情,请联系Bio X Cell授权一级代理商欣博盛生物
全国服务热线: 4006-800-892 邮箱: market@neobioscience.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州: 020-87615159
欣博盛代理品牌官网:www.nbs-bio.com
欣博盛品牌官网:www.neobioscience.net
